Zrozumienie immunoterapii raka
Immunoterapia to podejście terapeutyczne, które działa na układ odpornościowy pacjenta w celu zwalczania jego choroby. W przypadku raka nie atakuje bezpośrednio guza, ale stymuluje komórki odpornościowe zaangażowane w jego rozpoznanie i zniszczenie.
W ostatniej dekadzie w immunoterapii nastąpił rozkwit raka, z powodu eksplozji podstawowej wiedzy z zakresu immunologii raka. Rzeczywiście, ta choroba nie jest już rozpatrywana tylko z punktu widzenia guza, ale jako choroba środowiska guza i układu odpornościowego. To poprzez manipulowanie nimi komórki nowotworowe namnażają się spod kontroli. I dzięki zrozumieniu, w jaki sposób to osiągają, naukowcy mogą dziś zaproponować nowe rozwiązania terapeutyczne.
Komórki rakowe zakłócają sygnały układu odpornościowego
Ponieważ komórki rakowe pochodzą z organizmu, niektórzy naukowcy od dawna uważają, że powinni uciec od nadzoru układu odpornościowego. Prace opublikowane w latach 60. pokazują, że tak nie jest!
Komórki rakowe mają głębokie zmiany genetyczne, które pozwalają im uzyskać ich złośliwe właściwości. W ten sposób zaczynają wyrażać na swojej powierzchni cząsteczki specyficzne – antygeny
guzy – które odróżniają je od zdrowych komórek i są w stanie indukować reakcje immunologiczne. Jednak w miarę postępu choroby komórki nowotworowe nadal transformują się i dostosowują do swojego środowiska, aby wykorzystać je na swoją korzyść i dalej się rozmnażać. Zatem niektóre immunogenne antygeny nowotworowe,
przestają być wyrażane: to zjawisko pozwala komórkom nowotworowym uniknąć nadzoru ze strony układu odpornościowego. Komórki te zaczynają również wytwarzać nowe białka, które inaktywują mechanizmy obronne organizmu. Zatem mikrośrodowisko guza jest ogólnie immunosupresyjne: może zapobiegać pojawieniu się limfocytów T lub ich działaniu. Ostatnio opisano kilka mechanizmów tego typu.
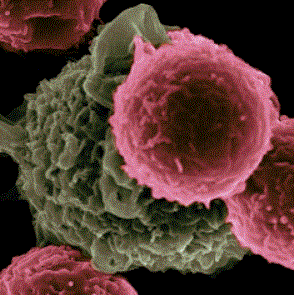
Immunoterapia przeciwnowotworowa ma na celu „przebudzenie” układu odpornościowego i jego edukację, tak aby eliminował komórki rakowe . Podejście to opiera się na zastosowaniu różnych narzędzi: szczepienia, przeciwciał monoklonalne, immunomodulatory.
Obraz skaningowego mikroskopu elektronowego pokazuje komórki dendrytyczne (na zielono), oddziałujące z limfocytami T (na różowo).
Victor Segura Ibarra i Rita Serda, National Cancer Institute, National Institutes of Health
Kluczowe mechanizmy przeciwnowotworowej odpowiedzi immunologicznej
Mechanizmy immunologiczne zaangażowane w odpowiedź przeciwnowotworową są liczne i złożone. Jeden z nich jest fundamentalny: dendrytyczne
rozpoznają antygeny nowotworowe i prezentują je limfocytom T w węzłach chłonnych w celu ich aktywacji. Limfocyty te docierają następnie do mikrośrodowiska guza, a konkretnie eliminują komórki rakowe, będące nosicielami tych antygenów. Tak zwanej odpowiedzi „adaptacyjnej” towarzyszy odpowiedź „pamięci”, która poprawia reaktywność układu odpornościowego w przypadku nowego spotkania z antygenem nowotworowym.
Ale odpowiedź przeciwnowotworowa mobilizuje wiele innych typów komórek: komórki prezentujące antygen, limfocyty B, komórki naturalnych zabójców, a nawet cząsteczki zapalne, takie jak cytokiny
.
Różne podejścia do immunoterapii
Zwiększ ogólną odpowiedź immunologiczną
Rozpuszczalne cząsteczki uczestniczą w funkcjonowaniu układu odpornościowego, w szczególności cytokiny (rodzina cząsteczek zawierających w szczególności interleukiny
i interferonami). Zsyntetyzowane przez niektóre komórki w odpowiedzi na sygnał, działają one zdalnie na inne komórki w celu regulacji ich aktywności i funkcji. Zwiększenie liczby lub działania tych cząsteczek jest strategią stosowaną do wzmocnienia odpowiedzi immunologicznej. W tym celu stosuje się już dwa rodzaje cytokin:
interleukiny 2 (IL-2) w zaawansowanym raku nerki
interferon alfa 2b, niektóre białaczki i szpiczaki, a także czerniaki
Interleukiny 2 wykazują jednak znaczną toksyczność z ciężkimi zespołami zapalnymi. Jednak laboratorium opracowuje obecnie nieco zmodyfikowaną IL-2 („pegylowaną”), aby zmniejszyć ich niepożądane działanie bez zmiany ich skuteczności. Te ostatnie są bardzo obiecujące, z kilkoma badaniami klinicznymi w kilku nowotworach.
Innym sposobem na stymulowanie ogólnej odpowiedzi immunologicznej jest stosowanie szczepionek, w tym BCG (szczepionka przeciw gruźlicy) .
Jego podawanie pacjentom z rakiem pęcherza moczowego wiąże się z przedłużoną odpowiedzią przeciwnowotworową bez dotychczasowego jednoznacznego zidentyfikowania mechanizmu. Ma również wskazanie przeciwko temu rakowi jako czynnikowi terapeutycznemu.
Blokuj specyficzne sygnały nowotworowe
Blokowanie określonych białek na powierzchni komórek rakowych lub w ich mikrośrodowisku pomaga spowolnić interakcje między nimi, a tym samym wzrost guza. W tym celu można zastosować kilka rodzajów przeciwciał monoklonalnych , pod warunkiem, że pacjent ma białko docelowe w guzie.
Opracowane i stosowane od ponad dwudziestu lat, te przeciwciała monoklonalne wiążą się ze specyficznymi receptorami w komórkach nowotworowych lub mikrośrodowisku i hamują ich aktywność. Pierwszym z nich był rytuksymab, który jest wskazany w niektórych chłoniakach
. To przeciwciało monoklonalne jest skierowane przeciwko białku CD20 eksprymowanemu przez limfocyty B.
Wykazuje działanie toksyczne na te komórki. Trastuzumabem jest drugie przeciwciało skierowane przeciw białku HER2 ekspresji na powierzchni komórek niektórych nowotworów sutka (około 15%). Blokuje działanie tego receptora błonowego i hamuje wzrost guza. Thebewacizumab atakuje białko VEGF i hamuje jego działanie. Jest to wzrostu naczyniowy, związany z rakiem płuc, piersi lub jelita grubego. Jest o wiele więcej.
Niedawno pojawiły się przeciwciała bispecyficzne . Rozpoznają jednocześnie dwie różne cząsteczki i dlatego mogą łączyć dwa typy komórek, w szczególności komórkę rakową i limfocyt T zdolny do jej zniszczenia. Tak jest na przykład w przypadku blinatumomabu wskazanego w leczeniu ostrych białaczek limfoblastycznych.
Niektóre przeciwciała monoklonalne nazywane są immunomodulatorami : zwiększają mechanizmy hamowania układu odpornościowego indukowane przez nowotwór. Zatem ipilimumab blokuje oddziaływanie molekularne CTL4A / B7 między komórkami dendrytycznymi i limfocytami T, które blokują odpowiedź immunologiczną. Inne przeciwciała, w tym pembrolizumab lub niwolumab , blokują interakcję PDL1 / PD1 między komórkami nowotworowymi i limfocytami T, co sprawia, że te pierwsze są niewidoczne dla tych drugich. Mechanizmy te są wspólne dla wielu nowotworów, a te ostatnie terapie wskazują na już siedem rodzajów raka: płuca, nerki, pęcherz, głowę i szyję, czerniak
, Choroba Hodgkina i choroba Merkel. Są one obecnie oceniane w wielu innych nowotworach.
Po wstrzyknięciu przez krew leki te działają ogólnoustrojowo na guzy pierwotne i przerzuty. Lecz poprzez aktywację odpowiedzi immunologicznej, zabiegi te nie są pozbawione niepożądanych efektów: są one w szczególności związane z reakcjami autoimmunologicznymi na zdrowe komórki organizmu. Ponadto odsetek respondentów jest dość niski, od 20% do 40% w zależności od raka. Ale niezwykłe i długotrwałe reakcje są czasami obserwowane u osób z zaawansowanym rakiem z przerzutami.
Uzbrój układ odpornościowy na nowotwór
Terapia komórkowa i komórki CAR-T
Jedną strategią jest genetyczna modyfikacja komórek odpornościowych pacjenta, aby uzbroić je w nowotwór. Łączy terapię genową i terapię komórkową . Konkretnie, limfocyty T są pobierane z krwi pacjenta i modyfikowane in vitro, aby doprowadzić do ekspresji określonych receptorów na ich powierzchni, które rozpoznają antygen nowotworowy. Po modyfikacji komórki te nazywane są CAR-T (dla chimerycznych receptorów antygenowych T)), są rozmnażane w laboratorium i ponownie wstrzykiwane w dużych ilościach do ciała pacjenta, gdzie idą w celu zniszczenia komórek rakowych. Ta strategia rozpoczęła się w 2017 r., Wprowadzając na rynek dwa leki. Jeden jest wskazany w przypadku białaczki dziecięcej i białaczki młodych dorosłych (z około 70% odpowiedzią), a drugi w przypadku chłoniaków u dorosłych. Niestety wyniki testów guzów litych są dość rozczarowujące. Ponadto nie udało się rozwiązać trudności w wytwarzaniu tych środków w sposób bezpieczny i wydajny dla dziesiątek tysięcy pacjentów.
Przeczytaj także o komórkach CAR-T
Szczepionki terapeutyczne
Celem szczepień terapeutycznych jest stymulacja i ukierunkowanie układu odpornościowego w szczególności na komórki rakowe, poprzez podanie mu antygenu nowotworowego zdolnego do wywołania skutecznej odpowiedzi immunologicznej. Te szczepionki przeciwnowotworowe są spersonalizowane i dostosowane do guza pacjenta, zgodnie z ich profilem molekularnym. Kilka z nich jest testowanych, ale tylko jeden jest obecnie na rynku: Sipuleucel-T , przeciw rakowi prostaty. W przypadku tego podejścia konieczne jest pobranie komórek dendrytycznych od pacjenta z próbki krwi. In vitrokontaktują się z antygenem nowotworowym występującym w 95% przypadków raka prostaty (fosfatazy kwasu prostaty). Wstrzykiwane do ciała pacjenta, że obecny antygen limfocytom T, aby wywołać odpowiedź cytotoksycznych przeciwko komórkom rakowym. Operację należy powtórzyć trzy razy, w odstępie dwóch tygodni.
Takie podejście wymaga, aby układ odpornościowy nie był „zablokowany” przez nowotwór. W takim przypadku należy rozważyć połączenie z immunomodulatorem w celu usunięcia tego hamowania.
Szczepienie przeciwnowotworowe ma dużą zaletę: pozwala na wywołanie „pamięci” odpowiedzi immunologicznej, która teoretycznie powinna chronić pacjenta przed nawrotem.
Immunoterapia dotyczy wielu innych dziedzin terapeutycznych
Odporność bierze udział w kontroli wielu chorób, a immunoterapia jest już stosowana w kilku obszarach:
Zakaźna choroba Oczywiście, ze szczepionek profilaktycznych polegające na edukację układ immunologiczny rozpozna i wyeliminuje czynnika zakaźnego, zanim nastąpi faktyczne infekcji. Szczepienie obejmuje limfocyty pamięci, które trwale chronią zaszczepione osoby. Ponadto wstępne próby z udziałem immunomodulatorów przyniosły zachęcające wyniki przeciwko HIV . Receptory inhibitora PD-1 faktycznie opisano na powierzchni limfocytów T u pacjentów z AIDS, a zniesienie tego hamowania przez przeciwciała anty-PD-1 poprawia odpowiedź przeciwwirusową.
W alergicznych chorób zapalnych lub chorób autoimmunizacyjnych , odpowiadające odpowiednio utracie kontroli odpowiedzi odpornościowej po ekspozycji na alergen albo samych komórek. Do alergii już do czynienia z immunoterapią (odczulanie) przez przyzwyczajanie układ odpornościowy toleruje alergen postępującym podawaniem tych ostatnich. Leczenie chorób autoimmunologicznych wymaga również modulacji układu odpornościowego przy użyciu immunosupresantów lub przeciwciał monoklonalnych (anty-TNF alfa, anty-IL-1, anty-IL-6, anty-IL-12 / IL -23 …).
Do chorób neurodegeneracyjnych , w tym choroby Alzheimera . Kilka badań w ostatnim czasie wykorzystuje przeciwciała monoklonalne lub terapeutycznego szczepienia w celu zwiększenia eliminacji peptydu amyloid beta, niestety bez powodzenia. Ale jego praca sugeruje rolę stanu zapalnego i odporności w początku tej choroby. Celowanie w układ odpornościowy stanie się prawdopodobnie nową strategią walki z nim.
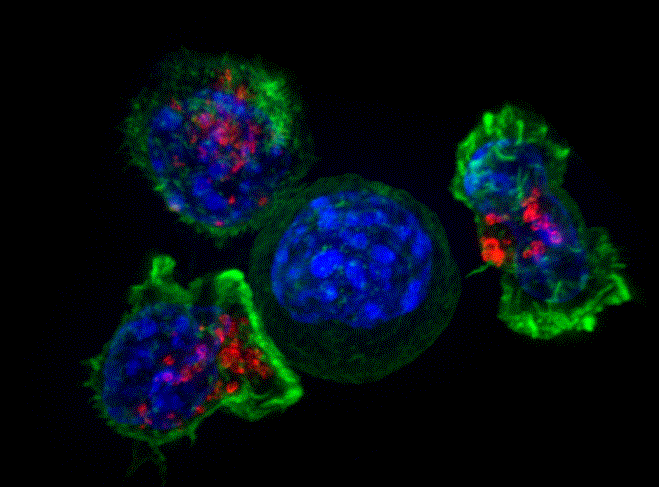
Alex Ritter, Jennifer Lippincott Schwartz i Gillian Griffiths, National Institutes of Health.
Obraz w super rozdzielczości grupy zabójczych komórek T (zielony i czerwony) otaczających komórkę rakową (niebieski, środkowy).
©
Piktogram mikroskopu Wyzwania badawcze
Lepiej zrozumieć przeciwnowotworową odpowiedź immunologiczną
Wiele pozostaje do zrobienia, aby nadal opisywać odporność na raka. Zespoły pracują na przykład nad limfocytami T CD4 . Ta populacja limfocytów nie ma bezpośredniego działania na komórki rakowe, ale uwalnia cząsteczki przekaźnikowe współpracy komórkowej, promując niszczenie komórek rakowych.
Przeczytaj także na ten temat: Lionel Apetoh: Stawiamy na nowy sposób immunoterapii przeciwnowotworowej
Inni pracują nad chemokinami . Cząsteczki te przyciągają komórki odpornościowe do tkanek zapalnych i nowotworów, ale mogą być degradowane przez enzymy, które w ten sposób ograniczają napływ limfocytów T. Na przykład chemokina CXCL10 jest degradowana przez enzym dipeptydylopeptydazę 4 (DPP4) przypadki raka Badania przedkliniczne pokazują, że doustne przyjmowanie inhibitora DPP4 spowalnia rozwój kilku rodzajów raka u myszy . Połączenie tego inhibitora z immunomodulatorem dodatkowo zwiększa ten efekt.
Na koniec zidentyfikowano ponad 300 receptorów hamujących lub aktywujących układ odpornościowy na